TAVR是如何诞生的
医声医事 好医生 2021-03-25 09:00:00TAVR技术自诞生至今,在器械设计及临床应用上已经取得了长足进步,臻于成熟。
TAVR技术凭借其在适应症患者的临床应用中获得的良好表现,正在逐步重塑主动脉瓣疾病的诊疗模式。
2019年新英格兰医学期刊(NEJM)公布的PARTNER 3研究,进一步证实了在外科手术风险低危的症状性主动脉瓣狭窄患者中,TAVR治疗方式优于外科手术治疗,将这一技术的适应症从高危患者扩展到了中低危患者,为TAVR的临床应用和指南更新提供了有力的证据。1
我们很好奇,TAVR这一革命性的技术在诞生之初是什么模样?它是如何从论文中的天马行空走向产业化?这项造福全人类的划时代技术又将在未来走向何方?让我们先来一起寻根溯源。
一、TAVR概念的诞生
1989年,来自丹麦奥尔胡斯大学医院的Henning Rud Andersen医生在美国一场大会上听取了冠脉支架的学术报告后,突发奇想,可以用支架支撑瓣膜假体,辅以球囊扩张,从而治疗主动脉瓣狭窄。
他设计支架、瓣叶、输送系统,并开展动物实验,率先完成了TAVR瓣膜早期原型支架的设计。
动物试验有所成效后,他一直在各个学术大会上提案、发布论文,但当时的学者们并不看好这门技术。
经过不懈努力,Andersen医生的发明于1995年获得了专利认证(著名的TAVR Andersen Patent,见下图),该专利之后被Andersen医生授权给了HeartPort公司(2000年该公司被强生公司收购)。

1995年美国专利授权Andersen介入瓣膜(著名的TAVR Andersen Patent)
1. TAVR的产业化之路
提到TAVR的产业化之路,就得说到著名的PVT公司。
法国的介入心脏病专家Alain Cribier,也是球囊成形术(BAV)的发明人。1980年代,Dr. Cribier在使用球囊成形术治疗主动脉瓣狭窄的过程中,发现该疗法无法提供长期的症状和血流动力学缓解2,于是他下定决心要进一步研究主动脉瓣置换术。
时间来到1996年,TAVR瓣膜尚处于研发阶段,Alain Cribier教授获得了强生的科研赞助经费,从而结识了时任强生医学官的Marty Leon,业务负责人Stanton Rowe和工程师Stanley Rabinovich。四人排除万难,最终在1999年成立了PVT公司,开始专注研发球囊扩张经导管主动脉瓣膜原型产品,走上了TAVR创业之路。
期间团队不停改造技术:瓣叶从聚合材料改进到生物材料,反复进行瓣膜开闭功能测试、并不断改进输送系统。
终于,2000年8月,首例动物实验非常成功,一个月后Alain Cribier教授在TCT大会上就发表了动物研究报告。
2. 从0到1,TAVR的First-In-Man之路
经过多年研发改进,2002年4月16日,介入心脏病专家Alain Cribier在法国查尔斯尼科尔大学医院进行了世界上第一例人体TAVR术。该手术使用的就是他在PVT公司自主研发的经导管主动脉瓣膜系统。
患者是一名57岁的中老年男性,找到Dr. Cribier时,射血分数已低至10%(而正常值为50%-70%),并伴有双侧股动脉瘤,心源性休克等并发症,这些都是外科主动脉瓣替换术的禁忌,也因此被2家外科中心拒绝手术,几乎陷入绝望。
起初,Dr. Cribier使用主动脉瓣球囊成形术(BAV)治疗,但第二天患者还是休克了。当时团队研发的是经股动脉置换技术,而患者患有双侧股动脉瘤,更可怕的是,患者左心室还伴有血栓,救治任务因此陷入了僵局。
这意味着这个团队面临了成立以来最艰难的抉择:做这台手术大概率会失败,公司有可能因此一蹶不振甚至倒闭;不做手术,就要眼睁睁看着这位病人被病魔剥夺生命。耗时数年的研究和心血,真的要赌上整个公司的命运选这样一位浑身并发症,被其他外科中心拒绝的病人来做这第一台手术吗?
在思考是否要为患者开展TAVR手术的那个晚上,他们发现这更多的是一个人道主义问题,而不仅仅是商业问题。如果不是为了救助患者,那发明瓣膜的意义又在哪里。
2002年4月16日,Dr. Cribier在法国查尔斯尼科尔大学医院,为这位几乎被医学界放弃的患者,进行了世界上第一例人体TAVR手术。
Dr. Cribier在患者心脏停跳期间完成了整个手术,仅在一小时内,患者便从面无血色到暗沉再到红润。当天晚上,这位从死亡线上徘徊过的患者就能够坐起来举着香槟和Dr. Cribier聊天。
这毫无疑问是个奇迹,一个人类医学进步的奇迹!在这台手术成功前,谁也没能想到这项技术竟然能如此快地作用在患者身上。
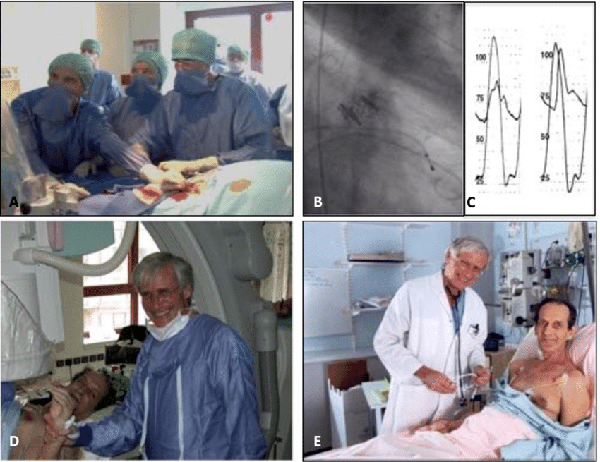
Figure 5 Alain Cribier教授于2002年4月16日,完成了世界上第一例TAVR手术
(图片版权:March 2017Global Cardiology Science and Practice 2016(4)
DOI: 10.21542/gcsp.2016.32
Authors: Alain Cribier)
TAVR技术终于开始在人体上进行了越来越多的运用,也积累了越来越多的革新和进步。
自2002年第一例手术到2005年Dr. Cribier开展的第一个临床研究系列: I-REVIVE and RECAST,该研究共入组了40位患者。
这40位患者和First-in-man的情况如出一辙——身体状况极差。一项全新的技术应用在濒死的病人身上,团队成员的每一次手术都身负极大压力。
40位患者中,有4位在术后存活了5年以上,1位存活了6年半,并且没有明显的瓣膜衰败迹象。
特别要提到的是一位术后存活6年半的3号病人。她是一名83岁的高龄女性患者,送到医院时是带有心源性休克并发症的重症患者,几乎濒临死亡。这位83岁高龄的患者仅在术后第15天便在医护人员的搀扶下成功出院;术后6个月参加了家庭聚会,享受了病重以来难得拥有的天伦之乐;1年后,这位状态越来越好的老奶奶还参加了在美国华盛顿举办的TCT大会,一起见证了这场划时代医学科技的进一步发展;在接下来的几年里,她和正常健康人一样生活娱乐,吹奏自己喜欢的乐器,甚至还可以做一些运动。
2002年开始,全世界各地合计完成100例TAVR手术,用了3年时间。
彼时,TAVR手术只能作为濒死患者的人道主义救治手段。
3. TAVR产业化改进之路
2004年爱德华生命科学收购了专注于TAVR产品开发的PVT公司,从此开启了TAVR商业化的新纪元,PVT公司的全部主创团队都加入了爱德华继续工作,直至退休。
从2005年到2012年间,爱德华的TAVR产品已经改良到了第三代,使得瓣膜本身有了多个尺寸的选择,输送器的导管鞘最低缩减到只需要14F,瓣叶的材质从马心包改进为抗钙化处理的牛心包,手术的入路也增加了多种选择。
4. 全球现状
TAVR,作为一个前沿的技术,在全球范围内的应用达到了井喷式的增长。
2002年,自法国的Alain G. Cribier教授开展了首例人类TAVR算起,至今全球已有超过65个国家开展TAVR ,年手术量达8万例。
预计到2025年,这一数字还将增长4倍,达到每年30万例以上。3
在中国,葛均波院士于2010年完成了我国首例TAVR手术。截至目前,中国已经有来自20余个省市的200余家医院顺利开展TAVR手术,累计病例数已经超过了5000多例。4
2019年8月16日,美国FDA批准了TAVR适应症拓宽到低风险的主动脉瓣膜狭窄患者。
5. TAVR的主要研究
TAVR相关的研究进展很多,尤其是PARTNER系列的随机研究,充分证实了TAVR相较外科手术的优秀疗效。

从以上研究表明,无论是否有外科手术风险,TAVR都能够作为主动脉瓣狭窄患者的手术选择之一。
6. 未来展望
未来,TAVR很有可能成为大量主动脉瓣狭窄病人的选择。TAVR的优势明显超出了目前可能有的限制。
2019年发表的PARTNER 3试验数据表明,相比SAVR,TAVR在相似的死亡率、卒中率和瓣周漏率情况下,能降低大出血、急性肾损伤等风险的发生率,能明显改善血流动力学性能,提供更快的愈合周期。8,9
随着人口老龄化,心脏瓣膜疾病比例也将越来越高。10
使用更为适合老年群体的TAVR手术进行治疗,将会造福更多患者。
7. 写在最后
回看那些年一步一个脚印的历史,从一个冠脉球囊支架的奇思妙想到第一位病患的“起死回生”,再到如今TAVR在全球的应用,离不开一位又一位勇于创新、患者为先的医师:他们的坚持让这项技术有了发展的可能,他们的钻研让这项技术有了救死扶伤的能力,他们的人道主义精神让这项技术得到应用,他们不断革新和进步,最终创造了这一项造福人类的医学奇迹。
而我们恰巧见证了TAVR开启的新纪元:
2002年,最初,无法做外科手术的患者才被推荐到TAVR手术;
未来,也许无法做TAVR手术的患者才会被推荐到外科手术。3
参考文献
(1) Mack, M. J.; Leon, M. B.; Thourani, V. H.; Makkar, R.; Kodali, S. K.; Russo, M.; Kapadia, S. R.; Malaisrie, S. C.; Cohen, D. J.; Pibarot, P.; Leipsic, J.; Hahn, R. T.; Blanke, P.; Williams, M. R.; McCabe, J. M.; Brown, D. L.; Babaliaros, V.; Goldman, S.; Szeto, W. Y.; Genereux, P.; Pershad, A.; Pocock, S. J.; Alu, M. C.; Webb, J. G.; Smith, C. R. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. New England Journal of Medicine 2019, 380 (18), 1695–1705. https://doi.org/10.1056/NEJMoa1814052.
(2) Brecker, S. J. Percutaneous Balloon Aortic Valvotomy for Native Aortic Stenosis in Adults. 12.
(3) 张海彤; 吴永健. 经导管主动脉瓣置换术史上跨时代意义的临床研究及影响. 中华心血管病杂志(网络版) 2019, 02 (01), 1–9. https://doi.org/10.3760/cma.j.issn.2096-1588.2019.1000023.
(4) QICC2020|葛均波:我国心血管介入治疗发展未来可期 -- 严道医声网 https://www.drvoice.cn/article/6119 (accessed Mar 12, 2021).
(5) Smith, C. R.; Leon, M. B.; Mack, M. J.; Miller, D. C.; Moses, J. W.; Svensson, L. G.; Tuzcu, E. M.; Webb, J. G.; Fontana, G. P.; Makkar, R. R.; Williams, M.; Dewey, T.; Kapadia, S.; Babaliaros, V.; Thourani, V. H.; Corso, P.; Pichard, A. D.; Bavaria, J. E.; Herrmann, H. C.; Akin, J. J.; Anderson, W. N.; Wang, D.; Pocock, S. J. Transcatheter versus Surgical Aortic-Valve Replacement in High-Risk Patients. New England Journal of Medicine 2011, 364 (23), 2187–2198. https://doi.org/10.1056/NEJMoa1103510.
(6) Leon, M. B.; Smith, C. R.; Mack, M.; Miller, D. C.; Moses, J. W.; Svensson, L. G.; Tuzcu, E. M.; Webb, J. G.; Fontana, G. P.; Makkar, R. R.; Brown, D. L.; Block, P. C.; Guyton, R. A.; Pichard, A. D.; Bavaria, J. E.; Herrmann, H. C.; Douglas, P. S.; Petersen, J. L.; Akin, J. J.; Anderson, W. N.; Wang, D.; Pocock, S. Transcatheter Aortic-Valve Implantation for Aortic Stenosis in Patients Who Cannot Undergo Surgery. New England Journal of Medicine 2010, 363 (17), 1597–1607. https://doi.org/10.1056/NEJMoa1008232.
(7) Leon, M. B.; Smith, C. R.; Mack, M. J.; Makkar, R. R.; Svensson, L. G.; Kodali, S. K.; Thourani, V. H.; Tuzcu, E. M.; Miller, D. C.; Herrmann, H. C.; Doshi, D.; Cohen, D. J.; Pichard, A. D.; Kapadia, S.; Dewey, T.; Babaliaros, V.; Szeto, W. Y.; Williams, M. R.; Kereiakes, D.; Zajarias, A.; Greason, K. L.; Whisenant, B. K.; Hodson, R. W.; Moses, J. W.; Trento, A.; Brown, D. L.; Fearon, W. F.; Pibarot, P.; Hahn, R. T.; Jaber, W. A.; Anderson, W. N.; Alu, M. C.; Webb, J. G. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. New England Journal of Medicine 2016, 374 (17), 1609–1620. https://doi.org/10.1056/NEJMoa1514616.
(8) Carnero-Alcázar, M.; Maroto, L. C.; Cobiella-Carnicer, J.; Vilacosta, I.; Nombela-Franco, L.; Alswies, A.; Villagrán-Medinilla, E.; Macaya, C. Transcatheter versus Surgical Aortic Valve Replacement in Moderate and High-Risk Patients: A Meta-Analysis. European Journal of Cardio-Thoracic Surgery 2017, 51 (4), 644–652. https://doi.org/10.1093/ejcts/ezw388.
(9) Lazkani, M.; Singh, N.; Howe, C.; Patel, N.; Colón, M. J.; Tasset, M.; Amabile, O.; Morris, M.; Fang, H. K.; Pershad, A. An Updated Meta-Analysis of TAVR in Patients at Intermediate Risk for SAVR. Cardiovasc Revasc Med 2019, 20 (1), 57–69. https://doi.org/10.1016/j.carrev.2018.04.001.
(10) Bonow, R. O.; Greenland, P. Population-Wide Trends in Aortic Stenosis Incidence and Outcomes. Circulation 2015, 131 (11), 969–971. https://doi.org/10.1161/CIRCULATIONAHA.115.014846.
HSS杂志中文版首刊上海发行 将精选文献助中国骨科医生成长

诺诚健华广州基地获批开展商业化生产
