肌肉减少症与肿瘤预后的研究进展
医声医事 石汉平医生 2023-12-05 15:55:18
▋摘 要
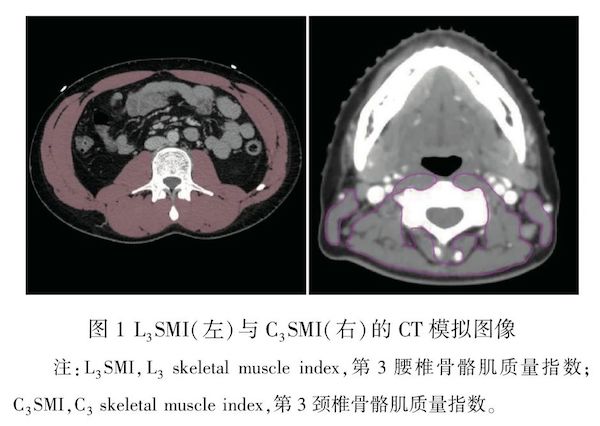
肌肉减少症是一种以进行性的、广泛性骨骼肌含量减少和功能减退为主要特点的综合征,肌肉减少症常见于老年人,不但会导致机体功能障碍,还会增加骨折、跌倒、并发症的发生甚至死亡风险。然而越来越多的研究发现,肌肉减少症高发于肿瘤患者,与恶性肿瘤相关的肌肉减少症,称为肿瘤相关性肌肉减少症。在消化道肿瘤、头颈部肿瘤、乳腺癌及肺癌等多种肿瘤中,肿瘤相关性肌肉减少症发生率高,不仅与化疗、放疗不良反应以及术后并发症相关,更严重影响患者的远期生存。目前对于肿瘤相关性肌肉减少症的研究处于探索阶段,尚需开展多中心、大样本、前瞻性循证研究,以进一步减少相关不良反应的发生,提高患者的生存质量。本文对肿瘤相关肌肉减少症的定义、评估及诊断标准,以及肿瘤相关肌肉减少症在不同肿瘤中,与肿瘤患者的治疗不良反应、术后并发症以及生存预后的相关性进行综述,旨在明确肌肉减少症在肿瘤患者预后中的重要临床价值,为进一步开展大规模临床研究提供依据。 关键词:肌肉减少症;肿瘤;肿瘤营养;预后 ▋正 文 肌肉减少症(sarcopenia)是由Rosenberg IH等[1]提出的一种随着年龄增长的进行性、全身肌肉量减少,肌肉强度下降,导致跌倒、残疾等不良事件的身体状态。2018年欧洲老年人肌肉减少症工作组2(European Working Group on Sarcopenia in Older People 2,EWGSOP2)及2019年亚洲肌肉减少症工作组(Asian Working Group for Sarcopenia,AWGS)对其定义及诊断流程等进行修订及完善,将肌肉减少症定义为进行性、广泛性的骨骼肌质量及力量下降,以及由此导致的身体残疾、生活质量下降及死亡等不良后果的综合征[2-3]。肌肉减少症常见于老年人,然而越来越多的研究发现,肌肉减少症高发于肿瘤患者,特别是在头颈部肿瘤及消化道肿瘤,肿瘤相关肌肉减少症发病率可高达12.5%~72.2%,不仅影响肿瘤患者的生活质量,还与放化疗毒性发生以及肿瘤预后密切相关[4-7]。 本文回顾近年肌肉减少症在不同肿瘤类型中的相关研究,对其诊断及预后价值等进行综述,为今后开展更多大规模肿瘤相关肌肉减少症临床研究提供证据与借鉴。 ◆ 1 肌肉减少症诊断标准 国际肌肉减少症工作组、2018年EWGSOP2及2019年AWGS共同完善了肌肉减少症的诊断标准,目前肿瘤相关肌肉减少症诊断过程及方法仍沿用此标准。该标准对肌肉质量(低肌量)、肌肉力量(低肌力)以及躯体功能(低体能)三个方面进行综合评估,见表1。 1.1 低肌量 对于肌肉质量的评估,采用双能X射线吸收技术(dual-energy X-ray absorption technology,DXA)、生物电阻分析法(bioelectrical im-pedance analysis,BIA)以及腹部计算机断层扫描(computed tomography,CT)等技术,计算四肢骨骼肌重量(appendicular skeletal muscle,ASM),并除以身高的平方得出四肢骨骼肌指数(appendicular skeletal muscle mass index,ASMI)。EWGSOP2使用DXA计算ASMI诊断界值为:男性<7.0kg/m2、女性<5.5kg/m2[8-9],而ASWG 2019使用男性<7.0kg/m2、女性<5.4kg/m2作为诊断界值。CT由于能够明确区分骨骼肌、脂肪和骨组织,并可通过三维成像技术测量肌肉横截面积,通过CT测量计算的第3腰椎骨骼肌质量指数(L3 skeletal muscle index,L3SMI)成为肌肉质量评估的“金标准”[10],其诊断界值设定为男性<52.4cm2/m2,女性<38.5cm2/m2,Beuran T等[11-12]也根据大量研究将国内诊断界值调整为男性为40.8cm2/m2,女性34.9cm2/m2。与体质指数(body mass index,BMI)相比,L3SMI提供了更多身体成分的信息,可能会更加准确地评估患者的营养状态。而在某些未能获取L3SMI的肿瘤中,如鼻咽癌,笔者团队的Hua X等[13]使用第3颈椎骨骼肌质量指数(C3 skeletal muscle index,C3SMI)进行研究并证实其诊断及预后价值。其CT模拟图像见图1。 1.2 低肌力与低体能 对于肌肉力量的评估,目前以握力进行评估,EWGSOP2诊断标准为,当男性握力<27kg,女性握力<16kg,即评定为低肌力,而ASWG 2019规定诊断标准为男性握力<28kg,女性握力<18kg。 躯体功能评估主要采用6m步行速度,≤1m/s及≤0.8m/s分别为欧洲及亚洲共识的标准。 ◆2 肌肉减少症在不同肿瘤中的研究进展及预后价值 越来越多研究认为,肿瘤相关肌肉减少症不但与抗肿瘤治疗互相影响,且与肿瘤患者治疗毒性及预后密切相关[14-16]。笔者团队结合前期研究及目前各种类型肿瘤相关肌肉减少症的研究进展,回顾总结其在不同肿瘤的研究价值如下。 2.1 鼻咽癌 鼻咽癌是我国南方常见的恶性肿瘤,主要治疗方式为同步放化疗,然而由于放化疗导致口腔黏膜反应、疼痛等不良反应,导致肌肉减少症在鼻咽癌中发生率较高。Huang X等[17]在394例非转移鼻咽癌中进行初次研究发现,重度的骨骼肌丢失可缩短患者的总生存(HR=2.79,P=0.002)。随后,Hua X等[14]对862例鼻咽癌患者进行了回顾性分析,通过CT图像计算C3SMI,按照18.82cm2/m2将其分为肌肉减少症组(19.7%)及非肌肉减少症组(80.3%),并在308例匹配队列中进行了验证。研究发现肌肉减少症患者5年总生存(overall survival,OS)期及无远处转移生存(distant metastasis free survival,DMFS)显著劣于非肌肉减少症患者,并且多因素分析证明肌肉减少症为OS期及DMFS的独立预后因素。同时发现,肌肉减少症组患者的应答率显著低于非肌肉减少症组患者,而治疗相关毒性反应发生率则显著升高。笔者团队结合了治疗前EB病毒DNA拷贝数及淋巴单核细胞比例(monocyte-to-lymphocyte ratio,MLR)分别构建S-E分级及S-M分级并建立诺曼图模型预测鼻咽癌生存[13,18],结合传统TMN分期显著提高了预测预后的准确性,肯定了肌肉减少症是鼻咽癌预后不良的因素。目前上述研究中研究人群均来自亚洲,地域性单一,同时仅凭借肌肉量对肌肉减少症进行诊断,需要进一步研究来证实。 2.2 胃癌 胃癌患者肌肉减少症的发生往往是肌肉减少症本身固有病因与胃癌特有因素共同作用的结果,包括摄入不足导致的营养不良、年龄因素、肿瘤自身代谢及化疗药物如顺铂导致肌肉损伤及肌肉无力[19-20]。2018年,Kuwada K等[21]对491例接受胃切除术的胃癌患者的研究表明,术前肌肉减少症是预测患者预后不良的独立危险因素(HR=1.46,P=0.045)。Lin JX等[22]纳入1167例接受根治性胃切除术的胃癌患者,同样发现,术前肌肉减少症是胃癌术后生存的独立预后因子(P<0.001)。Sugawara K等[23]结合预后营养因子(prognostic nutritional index,PNI)及术前肌肉减少症建立新的预后评分并证实其评价系统可以预测早期胃癌患者的生存结局。Zhou CJ等[24]进行了前瞻性的研究,共纳入240例年龄≥65岁的接受根治性胃癌手术患者,通过EWGSOP2及AWGS标准进行评价,肌肉减少症患者占28.8%,其术后并发症较非肌肉减少症患者增加24.7%,但缺乏生存数据。一项荟萃分析统计了20项研究,得出了一致的结论即肌肉减少症患者术后并发症显著增加[25]。目前胃癌中针对肌肉减少症的预后研究多关注术前肌肉状态,且结论基本一致,但发生率在不同研究中呈现明显差异性,诊断标准也尚未统一,较少研究术后或治疗后的肌肉减少症发生与预后的关系。 2.3 结直肠癌 目前对于结直肠癌患者肌肉减少症的报道亦多集中于术前阶段,术前肌肉减少症的发生率达15%~60%[26-29]。Vashi PG等[30]回顾性研究了112例大肠癌患者(包括58.9%的转移患者)术前肌肉减少症与肿瘤预后的关系,发现肌肉减少症患者的死亡风险是无肌肉减少症患者的3倍(P=0.001),中位生存期仅为14.6月。Da Cunha LP等[31]对转移性结直肠癌患者进行研究发现一致结论,肌肉减少症患者的中位无进展生存(progression free survival,PFS)期为7.2个月,显著短于非肌肉减少症患者的15.2个月。Reisinger KW等[32]的前瞻性研究中,肌肉减少症患者的30d院内死亡率为8.8%,非肌肉减少症患者为0.7%(P=0.001,OR=1.17),并可参与预测术后败血症的发生。目前多个结直肠癌的类似研究均得出一致结论,认为肌肉减少症会缩短患者生存期,增加术后死亡率[33-35]。 2.4 肺癌 肺癌是我国死亡率最高的恶性肿瘤。肌肉减少症在肺癌患者中发病率较高,达42%~52%[36-37]。目前研究发现,肺癌患者预后与肌肉减少症均有密切的关系。张浩等[38]对纳入112例Ⅲb~Ⅳ期非小细胞肺癌患者的研究进行回顾性分析,根据治疗前骨骼肌指数(skeletal musclemass index,SMI)将患者分为64例合并肌肉减少症组和48例非肌肉减少症组,发现合并肌肉减少症组的PFS、OS均低于未合并肌肉减少症组(P<0.05)。Buentzel J等[39]通过系统综述回顾了多种治疗方式下(手术、化疗、靶向治疗、放疗及综合治疗)肺癌患者的预后,发现肌肉减少症是患者OS期的独立危险因素(HR=3.13,P<0.05)。Suzuki Y等[40]对90例进行手术的肺癌患者进行研究,发现合并术前肌肉减少症的患者5年OS期及无病生存率(disease free survival,DFS)显著低于非肌肉减少症患者。Wang J等[41]发现肌肉减少症是非小细胞肺癌患者免疫治疗的独立危险因素(HR=1.61)。同时,多项研究表明,肌肉减少症患者较非肌肉减少症患者合并术后并发症、化疗及免疫相关毒性风险显著增加[42-45]。 2.5 乳腺癌 Villasenor A等[46]前瞻性纳入471例女性乳腺癌患者,肌肉减少症定义为低于年轻健康成年女性四肢肌肉质量平均值除以身高平方(<5.45kg/m2)的两个标准差,其中75例(16%)可诊断为肌肉减少症,肌肉减少症是OS的独立预后因素(HR=2.86)。Morlino D等[47]根据EWGSOP2调查了122例乳腺癌患者,发现13.9%的患者存在肌肉减少症。Zhang X等[48]对6项研究进行荟萃分析,同样发现与没有肌肉减少症的乳腺癌患者相比,肌肉减少症的乳腺癌患者死亡风险更高(合并HR=1.71)。此外,亚组分析显示,年龄小于55岁的肌肉减少症患者的死亡风险显著低于55岁及以上的肌肉减少症患者。Prado CM等[49]的前瞻性研究及Caan BJ等[50]的观察性研究分别在转移乳腺癌及非转移性乳腺癌患者,证实治疗后肌肉减少症分别缩短了肿瘤进展时间及OS时间。上述研究均表明乳腺癌合并肌肉减少症与患者的不良预后有关。 ◆3 小结 目前国内外肌肉减少症与肿瘤预后的研究尚处于探索阶段,且不同肿瘤中评价方式不一致。虽然大多数肿瘤相关研究肯定了肌肉减少症对肿瘤预后的影响但大多数为回顾性研究,因果论证能力有限,结论仍需进一步证实。未来需在统一肌肉减少症诊断标准的前提下进行更多大规模前瞻性研究来探索肌肉减少症在不同类型肿瘤的预后价值,并深入研究其发病机制,寻找更有效的治疗手段,以改善肌肉减少症肿瘤患者预后。






指纹为啥不重样?《细胞》揭示指纹形成之谜

医师节《渡劫指南》:劫后重生篇
