续写脱离输血“秘笈”,红细胞成熟剂打开MDS一线治疗新模式
骨髓增生异常肿瘤(即骨髓增生异常综合征,简称MDS)是一组起源于造血干细胞的异质性髓系克隆性疾病,特点是造血细胞发育异常,表现为无效造血、难治性血细胞减少和高风险向急性髓系白血病(AML)转化[1]。MDS根据预后积分系统可分为较低危组和较高危组[1],其中又以较低危组多见,占比可达77%[2-3]。临床上,85%的较低危MDS病例在诊断时就已经存在贫血,并依赖红细胞输注治疗[4]。治疗贫血、减轻输血负担已成为较低危MDS患者的主要治疗目标[1]。
近日,百时美施贵宝在美国临床肿瘤学会(ASCO)和欧洲血液学协会(EHA)年会上首次对外公布了3期COMMANDS研究结果,评估注射用罗特西普一线治疗较低危MDS成人贫血患者的疗效及安全性。对此,“医学界”特别邀请苏州大学附属第一医院血液科主任医师苗瞄主任基于已公布的研究结果,为广大医生做相关分享。
专家简介

苏州大学附属第一医院血液科主任医师 苗瞄教授
中华医学会血液学分会红细胞疾病组委员
中国老年医学学会血液学分会常委
中国老年医学学会血液分会MDS学术工作委员会副主任委员
中国MDS/MPN工作组专家委员会委员
江苏省医学会血液分会红细胞疾病组副组长
北京癌症防治学会红细胞疾病专业委员会常委
苏州市医学会血液学分会MDS/MPN学组组长
打破MDS一线治疗困境,新型红细胞成熟剂重磅登场
在中国,MDS的发病率约为1.5/10万[5]。对于MDS患者而言,慢性贫血已成为严峻的问题。数据显示,高达90%的MDS患者存在慢性贫血,从而导致死亡风险显著增加[6-7]。尽管并发贫血的MDS患者可通过定期输血改善贫血,但依然面临着重重挑战。苗瞄主任指出,贫血会降低机体的耐受性,使患者更易发生感染,而定期输血需要患者频繁往返医院,不仅会带来经济成本的增加,也会影响患者的生活质量和工作。而且,长期输血带来的铁过载也会影响脏器的功能。较低危MDS中位生存时间不足五年[12-15],而临床上,相较非输血依赖患者,输血依赖的较低危MDS患者死亡风险增加超过50%[8-11]。
在药物干预方面,尽管未获批相关适应症,但红细胞生成刺激剂(ESA)目前被认为是较低危MDS贫血症状的标准一线药物。然而,ESA似乎也并不能满足临床需求。其疗效和持续时间均有限,仅1/3患者对此治疗有应答且中位持续应答时间仅6-18个月[16-21]。
在种种困境下,红细胞成熟剂罗特西普走进学界视野。作为全球首创的红细胞成熟剂,罗特西普可作为配体陷阱,选择性结合转化生长因子-β(TGF-β)超家族配体,抑制其与受体结合,阻断Smad2/3信号通路,促进红细胞分化和成熟[22],进而改善无效造血(图1)。而研究发现MDS患者的骨髓细胞中通过Smad2/3通路的信号组成增加,Smad2/3通路成为治疗MDS贫血的有效靶点[23]。
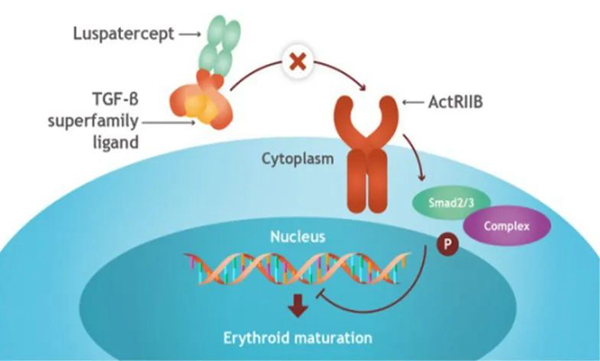
图1 罗特西普作用机制
当前,罗特西普已成为β-地中海贫血患者的治疗新选择,在MDS患者中的应用,也开展了多项研究,为MDS患者摆脱贫血与输血依赖带来了新希望。
罗特西普亮相国际大会,助力MDS摆脱红细胞输注依赖
近期,在2023年ASCO年会和EHA年会上,罗特西普3期临床研究COMMANDS结果重磅公布,为罗特西普一线治疗MDS患者提供了重要参考依据。
COMMANDS研究是一项开放标签随机研究,旨在评估罗特西普对比一种ESA——重组人促红素用于红细胞(RBC)输注依赖且未接受过ESA治疗的IPSS-R定义的极低危、低危及中危MDS成人患者的贫血。
研究评估的主要终点为1-24周内,摆脱红细胞输注(RBC-TI)≥12周,同时平均血红蛋白水平增加≥1.5 g/dL。关键次要终点包括1-24周期间至少8周的红系反应(HI-E),RBC-TI≥12周及RBC-TI 24周。
高应答,应答患者比例是对照组近两倍
截至期中分析时,罗特西普组和重组人促红素组的中位治疗持续时间分别为41.6周和27周。主要终点结果显示:在纳入疗效分析的301例患者中,86名(58.5%)接受罗特西普治疗的患者以及48名(31.2%)接受重组人促红素治疗的患者实现了RBC-TI≥12周且血红蛋白水平增加≥1.5 g/dL(P<0.0001)[24](图2)。该结果表明,罗特西普组达到主要终点的患者比例是重组人促红素组的近两倍,且在临床相关亚组中,均观察到了罗特西普带来的获益。

图2 COMMANDS研究达到主要终点患者比例
长维持,摆脱输血依赖中位时间超对照组一年
该研究也达到了关键次要终点,接受罗特西普治疗的患者较接受重组人促红素治疗的患者获得了更持久的治疗应答,两组RBC-TI≥12周(第1周至治疗结束)的中位应答持续时间分别为126.6周和77周(图3)。在治疗的前24周中,罗特西普组47.6%(n=70)的患者实现了RBC-TI 24周,而重组人促红素组的比例为29.2%(n=45)(p=0.0006)。罗特西普组74.1%(n=109)的患者实现至少8周的HI-E,而重组人促红素组的比例为51.3%(n=79)(p<0.0001)[24]。
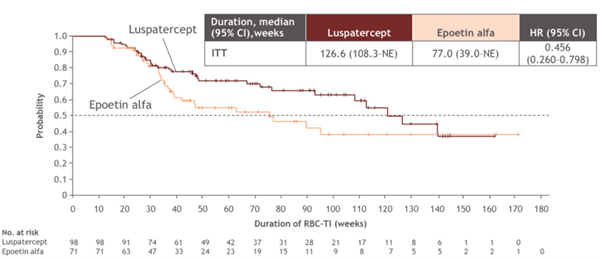
图3 COMMANDS研究两组中位应答持续时间
无惧基因突变,各类MDS相关常见基因突变患者均有获益
EHA年会上公布的研究结果显示罗特西普用于各类MDS相关基因突变的患者均展示出临床获益。对于常见的MDS基因突变(SF3B1、ASXL1、TET2、DNMT3A、EZH2、IDH2、U2AF1),无论总体突变负担如何,罗特西普的治疗结果均优于重组人促红素,并且实现临床获益的可能性更高。
苗瞄主任对研究结果进一步总结道:“通过COMMANDS研究数据,我们不难看出,对于RBC输注依赖且未接受过ESA治疗的较低危MDS成人患者,罗特西普能够迅速提升血红蛋白,大比例改善输血依赖的情况。值得注意的是,罗特西普在实现摆脱输血依赖以及提升血红蛋白数值上的有效率是传统ESA治疗的近两倍,且将中位应答持续时间延长了1年,这样的结果还是比较理想、很令人满意的。”
安全有效新选择,目前唯一红细胞成熟剂开创MDS治疗新格局
除了亮眼的疗效结果以外,在安全性方面,ASCO及EHA大会上公布的COMMANDS研究数据显示:164例(92.1%)罗特西普组患者以及150例(85.2%)重组人促红素组患者出现治疗期间不良事件(TEAE)。总体而言,罗特西普治疗后的患者没有出现新的安全性信号,耐受性较好。对此,苗瞄主任补充道:“接受罗特西普治疗的患者中并未观察到此前所担忧的一些治疗风险,比如红细胞上升后可能带来的血栓风险,罗特西普组安全性数据相较于对照组也没有太大差异,这一点与我们临床使用经验也是相符的。”
据了解,罗特西普是首个,也是目前唯一在与ESA头对头研究中显示出优势的疗法,其补充生物制品许可申请目前正在接受美国食品药品监督管理局(FDA)的优先审评,用于治疗可能需要红细胞输注且未接受过红细胞生成刺激剂治疗的极低危至中危MDS成人患者的贫血。
在访谈最后,苗瞄主任也表示了期待:“对于MDS患者而言,罗特西普是一款重量级的药物。此前,国内外陆续开展了罗特西普在ESA治疗失败或者不耐受MDS患者中的试验,已经积累了一定数据。此次ASCO和EHA的数据为后续罗特西普在MDS患者中的一线应用奠定了坚实的基础。期待罗特西普的MDS适应证早日在中国获批。同时,我们也期待能有更多的创新药物获批上市,帮助患者更早实现获益,从而减轻经济负担,进一步的延长患者的生存时间,改善患者生活质量。”
MDS的管理面临重重考验,无论是输血还是ESA均不能满足临床需求。罗特西普作为目前唯一的红细胞成熟剂,在MDS治疗领域展现出无限的潜力。期待罗特西普的MDS适应证早日在中国获批,为我国较低危MDS相关贫血带来新的治疗模式。
参考文献:
[1]刘琪英,李慧慧.临床药物治疗杂志,2022,20(08):7-11.
[2]Greenberg PL, et al. Blood. 2012;120:2454–2465
[3]Henry DH, et al. Am J Hematol. 2022;97:174–184
[4]Platzbecker U. Treatment of MDS[J]. Blood, 2019, 133(10): 1096-107.
[5]Wang W, et al. Ann Hematol. 2012;91(8):1321– 1322.
[6]Zeidan AM, et al. Blood Rev. 2019;34:1–15
[7]Malcovati L, et al. Haematologica. 2011;96:1433–1440
[8] Sekeres MA, Taylor J. JAMA. 2022;328:872–880
[9]Steensma DP. Blood Cancer J. 2018;8:47.
[10]Malcovati L et al. Haematologica. 2011;96:1433–1440
[11]Braga Lemos M et al. Eur J Haematol. 2021;107:3–23.
[12]National Cancer Institute. Accessed March 31, 2023.
[13] Cazzola M. N Engl J Med. 2020;383:1358–1374
[14] Madry et al. 2022 Br J Haematol 2023 Feb;200(4):451-461
[15]Greenberg et al. 2012 Blood. 2012 Sep 20;120(12):2454-65
[16] Platzbecker U. Leukemia 2017;31:1944–50
[17] Fenaux P, et al. Br J Haematol 2019;189:1016–27;
[18] Fenaux P, et al. Leukemia 2018;32:2648–58
[19]Park S, et al. J Clin Oncol 2017;35:1591–7
[20] Platzbecker, U. et al. Leukemia 2017, 31, 1944–1950.
[21]Park, S. et al. J. Clin. Oncol. 2017, 35, 1591–1597
[22] SURAGANI RN, et al. Nat Med, 2014, 20(4): 408 -414.
[23] Fenaux P, et al. N Engl J Med 2020;382:140-51.
[24]Garcia-Manero G,et al.ASCO 2023[Abstract #7003]

1122

收藏
热点资讯排行
- 1 世卫组织宣布批准辉瑞新冠疫苗紧急使用授权
- 2 5款COVID-19药物纳入欧盟优先加速审评:4款抗体 一款JAK抑
- 3 ESC公布数据表明:拜瑞妥显著降低肾功能保留的非瓣膜性房颤
- 4 8位首脑接种中国疫苗!美媒:中国疫苗成多国抗疫最可靠依赖
- 5 国家药监局公布药品网络销售典型案例 涉多个互联网平台
- 6 疫苗“加强针”,何时全民开打?
- 7 复星医药大跌5.11%,净流出3.37亿元
- 8 一文明晰Barrett食管内镜检查策略
- 9 优赫得在II期临床试验DESTINY-PanTumor02 中显示出对多种HE
- 10 美国政府下周起将向各州分发辉瑞新冠疫苗,医护等群体首先
精彩专题


























