艾伯维产品修美乐在华获批,用于治疗6岁及以上的中重度活动性儿童克罗恩病
·修美乐®(阿达木单抗注射液)已获国家药品监督管理局批准,用于治疗6岁及以上的中重度活动性儿童克罗恩病(ped CD),成为目前唯一在中国大陆获批的、可全程通过预填充式注射装置皮下注射治疗该疾病的生物制剂,为患者提供了一个灵活便捷的治疗选择。
·克罗恩病是一种累及肠道全层的、迁延不愈的慢性炎症性疾病。对于儿童患者而言,由于慢性腹泻、食欲减退及慢性消耗导致的营养障碍会严重影响其正常生长和青春期发育,表现为严重的发育迟缓,给患儿及其家庭带来重大的治疗、经济和心理负担。
·儿童克罗恩病(ped CD)适应症是修美乐®(阿达木单抗注射液)继类风湿关节炎、强直性脊柱炎、银屑病、成人克罗恩病、葡萄膜炎、多关节型幼年特发性关节炎、儿童斑块状银屑病之后,在华获批的第八个适应症,也是第三个儿童适应症。
近日,全球生物制药公司艾伯维(AbbVie)宣布,国家药品监督管理局已于2021年4月20日批准修美乐®(阿达木单抗注射液)用于治疗对对糖皮质激素或免疫调节剂(例如硫唑嘌呤、6-巯基嘌呤、甲氨蝶呤)应答不足的6岁及以上的中重度活动性克罗恩病的患儿减轻症状和体征,诱导和维持临床缓解。修美乐®(阿达木单抗注射液)是目前中国大陆唯一获批的、可全程通过预填充式注射装置皮下注射治疗该疾病的全人源TNFα单克隆抗体,为患者提供了一个新的治疗选择。这是修美乐®(阿达木单抗注射液)在华获批的第八个适应症,也是修美乐®(阿达木单抗注射液)在儿科领域获批的第三个适应症。
克罗恩病是一种累及肠道全层的慢性炎症性疾病,该病的慢性病程、迁延不愈以及易复发,又可合并肠外表现,并发症(如狭窄、瘘管或脓肿)可致手术等特性极大地影响了患者的生活质量。对于儿童患者而言,由于慢性腹泻、食欲减退及慢性消耗导致的营养障碍会严重影响其的正常生长和青春期发育,表现为严重的发育迟缓,给患儿及其家庭带来重大的治疗、经济和心理负担。儿童克罗恩的传统治疗,包括使用全肠内营养和皮质类固醇诱导缓解以及使用免疫调节剂进行持续药物治疗,但仍有部分患儿对传统治疗无应答甚至会因治疗加重生长障碍,临床亟需更有效的诱导和维持缓解的疗法和药物。
作为儿童用药且具有明显临床优势,此次修美乐®(阿达木单抗注射液)儿童克罗恩病适应症的申请获得了国家药品监督管理局药品审评中心(CDE)减免中国注册临床试验资格。其获批是基于两项评估修美乐®(阿达木单抗注射液)治疗ped CD的疗效和安全性的关键性全球随机双盲3期临床研究IMAGINE 1和其开放性拓展研究IMAGINE 2。IMAGINE 1研究显示,阿达木单抗开放性诱导治疗后(剂量:≥40kg的受试者为160/80mg,<40kg的受试者为80/40mg),双盲维持剂量方案(低剂量10mg,BW<40kg,或20mg,BW≥40kg;标准剂量20mg,BW<40kg,或40mg,BW≥40kg)可有效诱导和维持中重度CD的6至17岁儿童受试者的临床缓解至第52周。IMAGINE 2研究纳入成功完成为期52周的IMAGINE 1研究受试者(包含部分既往英夫利西单抗暴露患者),长达240周的阿达木单抗治疗维持稳定的临床缓解和应答率。IMAGINE 2 研究中,既往 IFX 暴露并不影响受试者的临床缓解和应答率。两项研究期间均未观察到新的安全性信号。
艾伯维全球副总裁、中国区总经理欧思朗表示:“得益于中国加速儿童创新药物审评审批的支持性政策的有效实施,修美乐®第三个儿童适应症—儿童克罗恩病适应症快速获批,有望为中国患儿及其家庭带来更优质、更便捷的治疗体验。作为免疫学领域的领导者,艾伯维不断努力兑现‘在华引入更多修美乐®适应症,提升患者特别是儿童患者的体验’的承诺;同时,我们也正在积极推进该领域更多的创新疗法在中国落地,期待能满足不同患者的治疗需求。”
2006年,修美乐®(阿达木单抗注射液)儿童克罗恩病适应症获美国食品药品监督管理局(FDA)“孤儿药”认定。目前,国际上已有包括美国和欧盟在内的86个国家和地区批准修美乐®(阿达木单抗注射液)用于儿童克罗恩病患者。
修美乐®(阿达木单抗注射液)用于治疗儿童克罗恩病的关键临床研究
一项多中心、随机、双盲临床试验中,根据体重(<40kg或≥40kg)调整给药剂量,对192例、年龄6至17岁(包括6岁和17岁)中重度儿童克罗恩病(定义为儿童克罗恩病活动指数(pcdai)评分>30)受试者进行本品诱导和维持治疗的疗效和安全性评价。受试者必须是经传统治疗(包括糖皮质激素和/或免疫调节剂)失败的克罗恩病患者,也可以既往英夫利西单抗无应答或不耐受。
所有受试者接受开放性诱导治疗,给药剂量基于其基线体重:对体重≥40kg的受试者,第0周给药剂量为160mg,第2周给药剂量为80mg;对体重<40kg的受试者,给药剂量分别为80 mg和40mg。
疗效结果
该研究的主要终点为第26周临床缓解(定义为PCDAI评分≤ 10)。
临床缓解和临床应答率详见表18,临床应答定义为PCDAI评分较基线下降至少15分。停用糖皮质激素或免疫调节剂的比率详见表19。
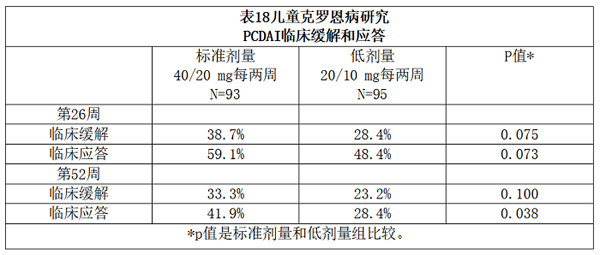
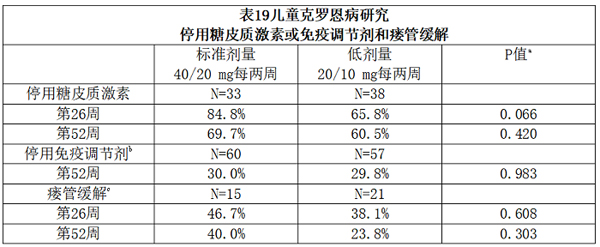
a p值是标准剂量组和低剂量组比较。
b 如果受试者满足临床应答标准,仅在第26周或之后根据研究者判断停用免疫抑制治疗。
c 定义为所有在基线时存在引流的瘘管在基线后至少2次连续随访时均闭合。
两个治疗组中均观察到从基线至第26周和52周体重指数和身高速度具有统计学意义地增长(改善)。
两个治疗组中也观察到生命质量参数(包括IMPACT III)与基线相比具有统计学和临床上的显著改善。
儿童CD研究中的100例患者(n=100)继续参加开放性长期扩展研究。经过5年的阿达木单抗治疗后,50例继续留在研究的患者中,根据PCDAI,74.0 %(37/50)的患者持续临床缓解,92.0 %(46/50)持续临床应答。

3212

收藏
热点资讯排行
- 1 诺诚健华将在2021年ESMO年会上公布奥布替尼联合CD20抗体MIL
- 2 TROPION-Breast01 III期试验发布最新结果:与化疗相比,Dat
- 3 拓益尿路上皮癌适应症全国上市会成都落幕,免疫治疗未来可
- 4 市监总局:13批次食品抽检不合格,涉及婴幼儿配方食品等
- 5 核心产品销售倍数级增长,基石药业上半年营收大增229%
- 6 “镭”霆峰会,“菲”凡同行——多学科探讨CRPC治疗的前沿访谈
- 7 新冠疫苗含铝佐剂伤大脑?太离谱!
- 8 《药品上市后变更管理办法(试行)》发布
- 9 赛可益®获批成为中国首个且目前唯一与标准治疗VRd联合的抗C
- 10 远大生命科学牵手丹诺医药 独家开展幽门螺杆菌创新治疗药物
精彩专题


























